NUMEROS CUANTICOS
La propuesta de Schrodinger , considerado como el 5° modelo atómico , radica en describir las características de todos los electrones de un átomo , y para ello uso lo que conocemos como números cuánticos .
Los números cuánticos se denominan con las letras n, m, l y s y nos indican la posición y la energía del electrón. Ningún electrón de un mismo átomo puede tener los mismos números cuánticos.
El significado de los números cuánticos es :
n = número cuántico principal, que indica el nivel de energía donde se encuentra el electrón, asume valores enteros positivos, del 1 al 7 .
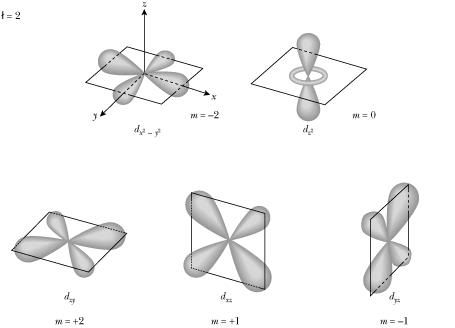
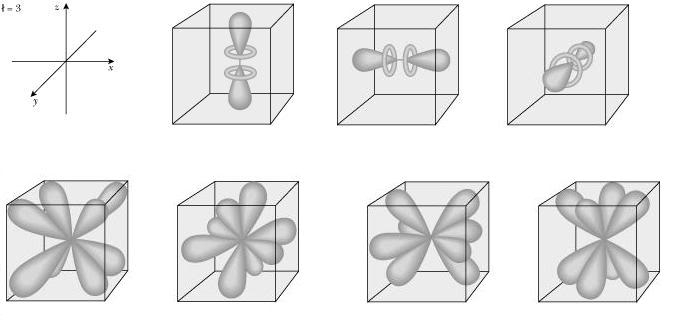
l = número cuántico secundario, que indica el orbital en el que se encuentra el electrón , puede ser s , p , d y f (0 , 1 , 2 y 3 ).
m = número cuántico magnético , representa la orientación de los orbitales en el espacio, o el tipo de orbital , dentro de un orbital especifico. Asume valores del número cuántico secundario negativo (-l) pasando por cero, hasta el número cuántico positivo (+l) .
s = número cuántico de spin, que describe la orientación del giro del electrón. Este número tiene en cuenta la rotación del electrón alrededor de su propio eje a medida que se mueve rodeando al núcleo. Asume únicamente dos valores +1/2 y -
En resumen los números cuanticos se expresan :
n : Nivel de energía (1, 2, 3, 4, 5, 6, 7)
l : Orbital (s=0, p=1, d=2 y f=3) de l =0 (orbital s) hasta n - 1.
m : magnético (m=-l ,0 +1) desde -l, pasando por cero,hasta +l.
s : spin (-1 , + 1 ).
Los números cuánticos sirven a su vez para entender la información que aporta la configuración electrónica
De esta forma se pueden obtener los números cuánticos de los electrones de los niveles superiores. Para mayor facilidad se presentará una tabla para asignar los números cuánticos correctos, conociendo la configuración electrónica y la localización exacta del electrón.
1s2/2s2 2p6/3s2 3p6/4s2 3d10 4p6/5s2 4d10 5p6/6s2 4f14 5d10 6p6/7s2 5f14 6d10 7p6
El número que precede al orbital es igual al número cuántico principal,por ejemplo para los electrones que están en el orbital 4p, el nivel = 4.
El número cuántico secundario se establece observando el orbital referido, por ejemplo para el orbital 4p , el subnivel es el orbital , l = 1 (p)
Orbital Equivalencia
s 0
p 1
d 2
f 3
El existen tres tipos de orbitales p (px , py y pz ) por lo que se dice que hay tres espacios donde se acomodan dos electrones en cada uno, esos espacios o tipos de orbitales reciben el número cuántico magnético de -1 , 0 y +1 . Es decir para el orbital p existen 3 números cuánticos magnéticos.
Orbital Tipos de orbitales Números cuánticos m Numero de electrones
s 1 0 2
p 3 -1 , 0 , +1 6
d 5 -2 , -1 , 0 , +1 ,+2 10
f 7 -3 , -2 , -1 , 0 , +1 , +2 , +3 14
De tal manera que dos electrones (los apareados) diferirán únicamente del número cuántico s o de spin , ya que uno tendrá s = - 1/2 y el otro s = + 1/2 .
este texto es tomado de la siguiente pagina
 http://payala.mayo.uson.mx/QOnline/numeros_cuanticos.html.[img]
http://payala.mayo.uson.mx/QOnline/numeros_cuanticos.html.[img]